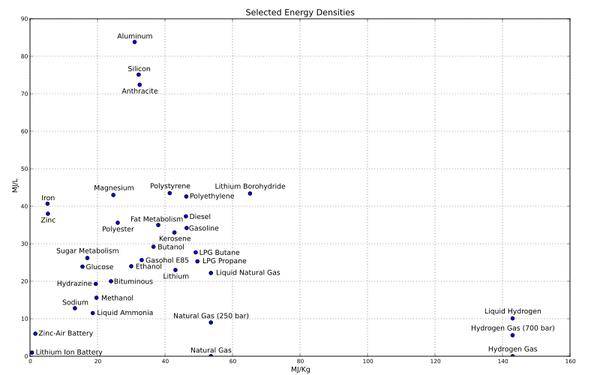
Tam olarak pil kapasitesini sınırlayan nedir? Bu problem için şunu görebiliriz: pil kapasitesi = enerji yoğunluğu x pil hacmi. Pil büyüklüğü doğal olarak nasıl yapılmalı, enerji yoğunluğu anahtarıdır. Sorusu şu şekilde anlaşılabilir: pilin mevcut enerji yoğunluğunu geliştirmek neden zor? Cümlenin basit cevabı, bataryanın arkasındaki kimyanın bataryanın enerji yoğunluğunu sınırlamasıdır. Wiki'den üretilen çeşitli enerji taşıyıcılarının enerji yoğunluğu. Cep telefonumuz, tabletimiz, notebook, saat ve tanınmış Tesla bataryalarımız lityum iyon akünün sol alt köşesinde kullanılır. Ve sonra benzin, dizel, bütan, propan, doğal gaz pozisyonu arayın. Çoğu kişinin aşağıdaki fikirleri bulacağı tahmin edilmektedir: 1) Pil teknolojisi çok zayıf2) pil teknolojisi gelecek vaat ediyor Bazıları daha iyi düşünürler3) Yakıt hücresi teknolojisi yarının yıldızı olacak. Benim fikrim: yukarıdaki halüsinasyonlar, halüsinasyonlar. .Takim kimya arkasındaki yakıt ile aküBu gözden geçirme (veya popüler) hakkında biraz bilgi sahibi. Hayatımızda gördüğümüz yakıt ve pillerin çoğu, bu tür enerji taşıyıcıları, çoğunlukla kimyasal redoks reaksiyonları ile ilgilidir. Enerji taşıyıcıları spesifik kimyasal işlemlerin dönüşümünde rol oynar, ancak her zaman bir redoks reaksiyonu içinde özetlenebilir. Redoks reaksiyonunun özü, elektronların indirgeyici ajandan oksidana aktarılmasıdır. Pil gibi hissediyor musunuz? Akünün negatif elektrotu bir indirgeyici maddedir ve pozitif elektrot bir oksitleyici maddedir (özellikle doğru değildir). Negatiflerden harici devre üzerinden katoda kadar olan elektronlar ve sonra da bu arada işler: ampuller, araçlar sürmek, cep telefonları ve bilgisayarları desteklemek. Elektronlar enerji kaynağı olduğundan, enerji yoğunluğunu tahmin edebiliriz. elektronların yoğunluğu. Burada, elektronların yapabileceği gücün tutarlı olduğunu varsayıyoruz (bu açıkça yanlıştır, aslında oksidan ve indirgeyici maddenin türüne bağlıdır, ancak genel batarya ve yakıt için dikkatlice incelendiğinde, bu ana faktör değildir) Enerji hacminin elektron yoğunluğu, hacim hesaplamasına bağlı olarak, esas olarak iki faktöre bağlıdır; Enerji taşıyıcısının hacim yoğunluğu. Katı> sıvı >>>>> gaz. Bu iyi bir anlayıştır.2. Enerji taşıyıcısının elektron transfer oranı. Kimya unutursa, bunu anlamak çok zordur; Bazı izlenimler varsa, bu da iyi bir anlayış. Atomların iç elektronları kimyasal reaksiyona katılmazlar ve doğal olarak transfer edilmezler. İşi sadece dış katman transfer eder. Elektron transfer oranı, reaksiyona katılan elektron sayısının toplam molekül sayısına oranıdır. Genel olarak, indirgeyici maddenin dış elektronlarının sayısı o kadar fazla değildir, fakat iç tabakaların sayısı artan atom sayısı ile birlikte artar. Daha da önemlisi, proton ve nötronlar arttıktan sonra atomların sayısı artar ve her ikisi de kalitenin ana kaynağıdır. Birkaç örnek verin: 1) H2-2e = 2H + hidrojen atomu, sadece reaksiyona katılan bir elektron, elektron transfer oranı% 100'dür 2) Li-e = Li + Lityum atomu üç elektrona sahiptir, sadece bir tanesi reaksiyona katılır, elektron transfer oranı 1/3 =% 33'tür 3) Zn-2e = Zn2 + Zn atomu sadece iki reaksiyona katılan otuz elektron var, elektron transfer oranı 2/30 =% 6,7'dir. Çoğu madde için, elektron transferinin oranı, daha önce bahsedilen nedenlerle çok düşüktür. Periyodik tablonun ilk iki satırındaki sadece hafif atomların iyi enerji taşıyıcıları olduğu görülebilir. Sadece 10 ilk iki element, hidrojen helyum lityum berilyum bor, karbon oksinitrid. Hangi helyum ve neon inert gazlardır, dışlama. Oksijen ve florin oksitleyici ajanlardır. Nitrojen çoğu durumda yarı-inert bir gazdır, inert bir gaz veya zehirli insanlar ölmeden sigara içmişse hariçtir. Hidrojen (% 100), karbon (% 66), bor (% 60), berilyum (% 50), lityum (% 33) olmak üzere beş element bıraktık, ayrıca bataryanın negatif kutbu olarak bir atom koyarsak. Daha sonra, yarı hücrenin enerji yoğunluğu (kütle birimi), aktarılan elektron sayısı ve atom ağırlığı ile tahmin edilebilir. O zamandan beri, yukarıdaki oran daha farklı olacaktır. Ayrıca referans olarak hidrojeni de alın: Karbon (% 4 / 12,33) Bor (3 / 10,8,28%) Berilyum (% 2 / 9,22) Lityum (% 1 / 7,14) Enerji taşıyıcısı için en uygun olan iki element karbon ve hidrojen ve aslında ortak benzin ve dizel yakıtlar ve diğer yakıtlar olan hidrokarbonlardır. Bu yüksek enerjili taşıyıcıların bir enerji kaynağı olarak otomobil seçimi, doğada zaten daha iyi bir çözümdür. Buna göre çeşitli hidrokarbonlara sahip bataryanın doğal olarak yetersiz olduğu söylenebilir. İkincisi: batarya ile ilgili büyük sorunlardan biri, elektrolitin çıkarılması Yukarıdaki açıklamaya göre, bataryanın yakıt yoğunluğunun aşılmasının zor olduğunu biliyoruz. Enerji yoğunluğu, ancak yakıt seviyesinin yarısına 1/4 seviyesine ulaşabiliyor gibi görünüyor. Bununla birlikte, gerçekte, bataryanın enerji yoğunluğu genellikle yakıtın% 1'inden daha azdır. Verilere inanmayın. Enerji yoğunluğu karşılaştırması: benzin 46.4MJ / Kg, lityum 43.1MJ / Kg, lityum pil (şarj edemez) 1.8MJ / Kg, lityum iyon pil 0.36 ~ 0.875MJ / KgIn aslında, enerji yoğunluğu benzin ve lityum gerçekten çok daha az. Bunun başlıca nedeni, karbondan oksijen elektronuna transfer çalışmasının yeterince büyük olmaması (kovalent bağ farklı olabilir) ancak lityumdan lityum piline kadar olmasıdır. The The Ve sonra lityum-iyon bataryaya ne oldu? Sebep açıktır. Lityum ya da lityum-iyon bataryanın içindeki metal lityum değildir, başka paralel ithalatlar da vardır. Bataryanın içindeki lityum içeriğini tahmin etmek için böyle bir formül buldum. Http://www.ponytest.com/document/battery.pdfM = 0.3 * Ah. Kelimelerin% 30 ile çarpılan batarya kapasitesi (güvenlik) bataryanın lityum içeriğini hesaplayabilir (g) Tanınmış 18650 (cep telefonu notebooku Tesla) batarya için, 42 g ya da daha fazla 2200mAh ya da öylesine, bu yüzden 2200/1000 * 0.3 = 0.66g lityum içeriği toplam ağırlığın yaklaşık% 1.5'i kadardır. Böylece bataryanın yalnızca lityum içeriğini yükseltebiliriz, enerji yoğunluğunu artırabilir! Gerçekten çok basit. Öncelikle lityum piline ve Lityum'a ek olarak neye bakıyoruz. Anlayamıyorum, onu dinleyebilirsin. Genel olarak, bataryanın dört bileşeni kritiktir: pozitif (deşarj katoddur), negatif (deşarj anottur), elektrolit, diyafram. Pozitif ve negatif, kimyasal reaksiyonun gerçekleştiği yerdir, önemli pozisyon anlaşılabilir. Ancak elektrolitlerin kullanımı nedir? Çalışmayın hala çok ağır. Sonra haritaya bakın. Şekilde pil şarjı ve boşalma süreci çok iyi. Burada ilk söylenen tek deşarj: pilin iç kısmı, negatif elektronlardaki metal lityum kaybı, elektrolit ile pozitif aktarıma kadar lityum iyonları olmak üzere oksitlenir; Elektron olmak üzere katot materyali azalır, pozitif lityum iyon nötrleşir. Elektrolitin ideal rolü sadece lityum iyonlarını taşımak ve taşımaktır. Akünün dışında, elektronlar negatiflerden dış devreden pozitif aktarıma, işin ortasında. İdeal olarak, elektrolit lityum iyonları için iyi bir taşıyıcı olmalıdır, ancak iyi bir elektron taşıyıcı olmamalıdır. Bu nedenle, harici devrelerin yokluğunda, elektronik batarya içindeki negatifden katoda aktarılamaz; sadece harici devrelerin varlığı, elektronik transfer gerçekleştirilebilir. ”Diyorsunuz ki” enerji taşıyıcıları belirli kimyasal işlemlerin değişim sürecine dahil oluyor, ancak her zaman bir redoks reaksiyonu ile sonuçlanıyor. “” Redoks reaksiyonunun özü, elektronların indirgeme ajanından oksidana aktarılmasıdır, “benzinli aracın bir elektroliti yoktur. Ama benzin yakan elektronik yanma vardır, onu çalıştıramazsınız? Evet, yanma elektron transferini içermelidir, daha sonra yanan elektron transferini ve akünün elektronik transferini temel olarak nerede farklı tutarsınız? Düzenli mi? Yanan elektron transferi mikroskobik kategoride tamamen düzensizdir. Yakıt ve oksijen moleküllerinin bir sonraki an yönünde nereye hareket edeceğini tahmin edemiyoruz, elektronların yönündeki yakıtın hangi oksijen moleküllerine aktarılacağını bilmiyoruz. 10 × 20-23 kez moleküllerin daha fazla elektronun rastgele transferi ile rastgele hareketi, düzensiz enerji salınımının veya basitçe söylenen ekzotermik sonucuna yol açar. Batarya, bakış açısından daha iyidir. Her bir molekülün batarya yörüngesindeki hareketini hala bilmemize rağmen, ancak en azından şunu biliyoruz: metal lityum yalnızca anot malzemesinin yüzeyini lityum iyonları haline kaybedecek; negatif başlangıçtan gelen lityum iyonları ve sonuçta katoda ulaşır. Elektronlar yalnızca anot malzemesinin yüzeyinden yüksek potansiyelin pozitif potansiyeline doğru hareket eder. 10 ^ 20-23 kez ortak hareketin elektronları, makrodaki akım buna deriz. Özetle Aktarmak için, elektronik aktarımı sipariş etmek için, bataryanın enerjisini değil, gerekli elektroliti taşıması gerekiyordu. çeşitli yardımcı malzemeler sayesinde enerji yoğunluklarını daha da azaltır. Bu bitti mi? Hayır. Ne yazık ki bu kısım sadece bir kaldırım. Üç: büyük sorunun bataryası, negatif yüzey malzemesiHerkese geri döndüm. Her bir çizgiyi okumakta ısrar edebiliyorsanız, burada okunmuş, tebrikler, batarya anlayışınız bir düzeyde olmuştur. Şimdi önceki bölümün içeriğini gözden geçirin. Ne? Hepsi unutuldu mu? Bir kelime değil mi? Hücrelerin enerji yoğunluğu, iş yokluğu, ancak gerekli elektrolitler ve diğer yardımcı malzemelerin varlığı nedeniyle seyreltilir. Bu ilave ağırlıkların ne kadarı sonunda bulunur? Elektrolitin ağırlığı tipik olarak akünün toplam ağırlığının% 15'ini oluşturur (bağlantı bulunamadı). Kabuğun, dış elektrotların ve diğer yardımcı malzemelerin sayıldığı tahmin edilmektedir, toplam ağırlık, bataryanın toplam ağırlığının% 50'sini geçmemelidir. Batarya 'su' ile karıştırılsa da, aynı zamanda fazla su olmamalıdır. Ah. Pazarın lityum-iyon batarya enerji yoğunluğu da yaklaşık% 1 lityumdur. Ona ne oldu? Neden bu cümle bu kadar tanıdık? Daha taze portakal içelim, en yaygın lityum kobalt oksit (Tesla Roadster) elektrokimyasal reaksiyonuna bakalım. Aslında lityum ve kobalt transferinin sadece bir kısmı, diğer elementler elektronda yer almıyor Daha sonra küçük bir hesaplama yaparız: Elemental lityum atom ağırlığı 6.9, elektronik transferde elektronik katılımına katkıda bulunabilir. Oksitleyici havadan gelir ve dikkate alınması gerekmez. Lityum kobalt oksit batarya ile tepkimeye giren tepkenlerin toplam moleküler ağırlığı 98 + 72 = 170 idi, ancak elektronların sadece yarısı elektron transferinde rol aldı. Çünkü lityum atomlarının sadece bir kısmı reaksiyona girecektir. İki elektronun çalışmasının aynı olduğunu düşünürsek, bu iki enerji taşıyıcı oranının enerji yoğunluğunu tahmin edebilirsiniz. Batarya enerji yoğunluğu: Yakıt enerji yoğunluğu = (0.5 / 170 ) / (1 / 6.9) = 2.03% Akü tamamlandı. Akünün yardımcı malzemenin ağırlığının yarısına sahip olduğu dikkate alındığında, ben bunu saymadım. Bu yüzden bir indirim yapmak zorunda. Kalan% 1. Böylece enerji yoğunluğu şöyle oldu: lityum 43.1MJ / Kg lityum-iyon batarya 0.36 ~ 0.875MJ / KgHa ha ha ha ha ha ha…… buna da ayak uydurabiliyor mu? Dört işlem daha basit ah. Şimdi ne olduğunu biliyorsun, değil mi? Şimdi neden söylediğimi anlıyor musunuz: Bataryanın arkasındaki kimya, bataryanın enerji yoğunluğunu sınırlandırıyor. Buna ek olarak sorumuz: bataryanın kimyasal reaksiyonunun neden bu kadar karmaşık olması, doğrudan bataryanın enerji yoğunluğunu azaltmak. daha karmaşık olunca, çoğu insanın okumaya sabrının olmadığı tahmin ediliyor. Yani basit bir cevap verin: Düzenli olarak. Pekala, sabır yok, gidebilirsiniz. Aşağıdakiler gerçekten uzun, ortalama bir insanı okuyamıyor. Resmin yayınlanmasından önce başla: Öğrencilerin geri kalanı, haritanın çok aşina olduğu değil mi? Aslında, lityum pil diyagramı, ancak bu kez katodik anot yüzey yapısı nedeniyle görüntülenir. Sence çok kurallar ah ah ah? Düzenli kurallar sıralamayı sırasına göre değiştirir. Neden yüzey yapısının pozitif kutbunun sipariş edilmesi gerekiyor? Redoks reaksiyonunun sadece şarj / deşarj sırasında pozitif ve negatif elektrotların yüzeyinde meydana geldiğinden emin olmak için gereklidir, böylece akım vardır. Olumsuz grafiğin (C6) olduğu yerde. Negatif direğin görevi çok basittir, elektronların negatif yüzeylerinde lityum atomlarının (iyonların değil) deşarjının kaybolduğundan emin olmak, onları şarj etmek ve daha sonra geri yakalamak. Şarj sırasındaki düşük anot gerilimi nedeniyle, pozitif yüklü lityum iyonları negatif elektroda doğru kendiliğinden hareket eder ve elektronlar lityum atomlarına geri döner. Bir kerelik pil ise, grafit gerekmez. Fakat eğer bataryayı şarj edip boşaltırsa, anot yüzey malzemesi grafit değildir, diğer maddeler olacaktır. Çocuğu satmayın ve en sonunda Editörün Notu TheHills Bu çok düşünce. Şarj ederken, elektronların negatif yüzeyindeki lityum iyonları lityum atomları haline gelir. ve sonra? Hepimiz biliyoruz ki tüm metaller iyi elektron iletkendir, lityum metaldir, bu yüzden lityum iyi bir elektronik iletkendir. Böylece, negatif lityum atomlarına birincisi, negatifin bir parçası haline gelir, daha sonra eski lityum saflarına eklenen negatif lityum iyonlarına geri döner. TheSo'nun tamamen lityum atomlarından oluşan kristalleri ortaya çıktı. Bu işlem aynı zamanda kristal olarak da bilinir. Sonuç olarak, lityum kristalinin diyaframı pozitif kutbuna deleceği, böylece akünün kısa devre hurdaya çıkacağı anlamına gelir. Bu olgunun kristalleşmesi için bunu anlayabiliriz. Şarj işleminde lityum iyonunun kontrolü gerçekten çok zayıf . Yalnızca lityum iyonlarının negatif yüzeye hareket etmesini sağlayabiliriz, ancak lityum iyonlarının negatif yüzeye eşit şekilde dağılmasını garanti edemeyiz. Bu nedenle, harici kısıtlamaların yokluğunda, lityum kristal belirsiz büyümenin negatif yüzeyinde, dendrit oluşumunda (dendritik kristal) yüklenecektir. Bu nedenle bir kısıtlama olmalıdır. Lityum iyonlarının sıçramasına izin verecek bir çukur kazmak. Bu çukurun spesifik performansı, grafit malzemesinin katod yüzeyidir. Yukarıdaki şekilde gösterildiği gibi, grafit katmanları arasındaki boşluk, tek bir lityum atomunu barındıracak kadar büyüktür, ancak sadece bir tek lityum atomunu; ve sonra grafit tabakası ile lityum atomu arasındaki fiziksel adsorpsiyon, lityum atomlarını tutabilir, Dış gerilim olmadığında, negatif yüzeyler olduğunda da rahat olabilir. Yani, lityum atomları acımasız bir büyüme olmayacak. Ancak enerji yoğunluğu artmıyor. Dört: Akünün üç büyük sorunu, pozitif yüzey malzemesi Lityum atomlarının her şarjda negatif elektrotun yüzeyinde, negatif elektrotun yüzeyinde düzgün ve üniform bir şekilde dağılmasını sağlamak için Lityum atomlarının dağılımını sınırlamak (sırayla, entropiyi azaltmak) için katılaşmış bir yapı gerektirir. Bu tasarım, bataryanın enerji yoğunluğunu büyük ölçüde sulandırır. Pozitif elektrot da aslında aynı soruna sahiptir. Lityum iyonlarının her bir deşarjda pozitif elektrotun yüzeyine düzgün ve üniform bir şekilde dağılmasını sağlamak için, pozitif elektrotun yüzeyinin lityum iyonlarının dağılımını sınırlamak (sırayla, entropiyi azaltmak) için katılaşmış bir yapı tabakasına ihtiyacı vardır. Bu tasarım, bataryanın enerji yoğunluğunu büyük ölçüde sulandırır. Fakat bundan daha fazlasıBu katot malzemesi şarjı ve deşarj yapısı şemadaki değişimlerdir. M, bir metal atomu temsil eder ve X, bir oksijen atomunu temsil eder. Bu rakamın çeşitli atomlarının boyutu ciddiye almaz. Lityum iyonları diğer ikisinden çok daha küçüktür. MX2'nin pozitif substratta çok yapılandırılmış (çok düzenli) yapıya sahip birkaç tabaka oluşumu, deşarjı, pozitif (pozitif) agregasyondaki elektronlar, lityum iyonlarının hareket ettiğini görebiliriz. Pozitif, aralığın MX2 yapısına serpiştirilmiş, böylece pozitif yüzeyde Sıralı dağılım. MX2'deki metal iyonları elektronik olarak indirgenir, böylece bir oksitleyici ajan olarak işlev görür. Bu yapının çökmesi üzerine cevap vermek imkansızdır. Bunun için pil katotundaki Set'in durdurulması yeterlidir, yani, pozitif yüzeyin yapının bütünlüğünü korumak için belirli bir miktarda lityum iyon bulundurması gerekir. Bu miktar, genellikle% 50'dir. Bu, önceki reaksiyonun bilinmeyen bir miktar x miktarına sahip olmasının nedenidir. Tam olarak dolu durumda bile, pozitif yüzeyde kalmak için lityum iyonunun neredeyse yarısı vardır. Bu nedenle enerji yoğunluğu daha düşüktür. Konu: Lityum pilin aşırı şarj edilmesinden, bir kez aşırı şarj edilmesinden, lityum-iyon akışının katodundan ve bu odun yığınının çökmesinden korkması nedeni budur. Beşinci: Büyük sorun dördüncü bataryadan, gerilmiş ve diğer malzemelerin seçimi, burada bulunan kişilerin, şarj edilebilir batarya tasarımındaki kısıtlamaların tamamen farkında olduğunu varsaymaktadır. Düzenli elektron transferini sağlamak için, lityum iyonları ve lityum atomlarının düzenli bir şekilde dağılımını sağlamak için, aküler elektrolitlere ve çeşitli yardımcı malzemelere ihtiyaç duyuyor, katod anot yüzeyinde enerji yoğunluğu pahasına olan düzenli bir yapıya ihtiyaç duyuluyor. Şimdi argümanıma geri dönelim: 1) pil teknolojisi çok zayıf: bu tasarımlar ne kadar zekice, açıkça insan bilgeliğinin neticesi. 2) pil teknolojisi umut verici: gelecekteki görünüm için gerçekçi bir tutuma sahip olmalıyız. Batarya teknolojisi 100 yıldan uzun bir süredir geliştirilmiştir, uzun süredir salgın dönemi olmuştur; fizik ve kimya teorisi için pil teknolojisinin gelişimini desteklemek, II. Dünya Savaşı'ndaki büyük atılımdaki büyük gelişmeleri sona erdi. Öngörülebilir gelecekteki batarya teknolojisi, bataryanın şu andaki gelişmesine dayanmalıdır. Sivil kullanım alanında bataryanın enerji yoğunluğu en sıkıntılı sorunlardan biridir, ancak çözülmesi en zor sorundur. Geçmiş batarya enerji yoğunluğu gelişmeye devam etti, çünkü bilim adamları daha küçük atom ağırlığı olan elementler arıyorlar. Böylece kurşun asitten nikel-kadmiyuma, nikel-kadmiyumdan nikel-hidrojene, nikel-hidrojenden mevcut lityum-iyon şarj edilebilir pil geliştirme sürecine tanık olduk, fakat daha sonra? İndirgeme ajanı: Başta dedim. Birkaç elementin üzerinde yüksek oranda elektron transferi: hidrojen, karbon, bor, berilyum, lityum. Şarj edilebilir bir batarya azaltıcı ajan olarak sadece lityum uygundur. Hidrojen, karbon yalnızca yakıt hücresinde ortaya çıkar. Bor, berilyum ana araştırma yönü değil, neden olduğunu bilmiyorum. Oksidan: Eğer geçiş metali kullanmazsanız, seçim ana grup elementlerinin üçüncü satırının ikinci satırıdır. Halojen yeterli değil, kalan oksijen ve kükürt. Gerçek şu ki, lityum hava pilleri (lityum oksit) ve lityum-kükürt piller üzerinde çalışacak çok insan var, ancak ilerleme iyimser değil. Neden? Çünkü batarya yüzey yapısı büyük bir sorun. Nanoteknoloji şimdi çok ilerleme kaydediyor mu? Bilim adamları, kesinlikle güzel ve düzenli bir yüzey yapısı tasarlayan nanotüp nanotüp nanosferleri nano-grafen grafen kullanabileceklerdir. Bu laboratuarlar birbirlerinden ayrılacak ve birkaç büyük haberi yayınlayacaklar. Fakat iki konu var, düşünmek isteyebilirsiniz.1) grafit, her zaman lityum pil anot malzemesinin seçimi olmuştur, aslında, sadece enerjiyi düşünürsek yoğunluğu, ardından metal kalay negatif bir malzeme olarak daha uygundur. Ama şimdiye kadar sony de kalay elektrot bataryası piyasaya sürdü (Sony nexelion 14430W1) Neden böyle? 2) Lityum kobalt okside ek olarak, mevcut diğer lityum batarya katod malzemesi aynı zamanda üçlü bir bileşik Li (NiCoMn) O2 lityum demir fosfat (LiFePO4) ) Bununla birlikte, sıkıştırma yoğunluğundan dolayı, bu malzemelerin kullanımı, bataryanın kapasitesi kobalt lityum batarya kadar değildir. İnsanlar neden çok çalışıyor?
Kaynak: Meeyou Karbür